جدول تناوبی شارل ژانت
جدول تناوبی شارل ژانت : همان طور که می دانید جدول تناوبی امروزی بر اساس تلاش ها و فعالیت های دیمتری ایوانویچ مندلیف شیمیدان روسی و همین طور فعالیت های مزولی شکل گیری شده است. مندلیف عناصر جدول تناوبی زمان خود را بر اساس جرم اتمی مرتب کرد اما با این روش چند مشکل در جدول ایجاد شد که بعد ها موزلی با مرتب کردن عناصر جدول تناوبی بر اساس عدد اتمی توانست تمامی نارسایی های جدول تناوبی مندلیف را توجیه کند. و بر اساس آن جدول تناوبی امروزی شکل گرفت.از سوی دیگر عناصری با عدداتمی ۱۲۰ و۱۲۱ درآزمایشگاه های تحقیقاتی ، به صورت مصنوعی ساخته شده اند ، که نمی توان آنها را درجدول تناوبی متداول امروزی قرار داد . ولی جدول پیشنهادی چارلز ژانت که در حدود ۵۰ سال پیش ارائه شده است به خوبی عناصری با عدد اتمی بیش از ۱۱۸ که اوربیتال s و g آن ها در حال پرشدن است را در خود جای می دهد.
اگر بخواهیم تاریخچه جدول تناوبی عناصر را یک بار مرور کنیم به صورت خلاصه می توان به موارد زیر اشاره کرد:
لوتر مایر
بدون شناختن مندلیف، لوتر مایر نیز در حال کار بر روی جدول تناوبی بود. هر چند تحقیق او در سال ۱۸۶۴ منتشر شد و به صورت مستقل از مندلیف انجام شده بود، بعضی از تاریخدانان او را به عنوان خالق مشترک جدول تناوبی در نظر میگیرند. برای اشاره باید بدانیم که جدول مایر دارای ۲۸ عنصر بود. علاوه بر این، مایر عناصر را بر اساس وزن اتمی مرتب نکرده بود و فقط بر اساس والانس مرتب کرده بود. در آخر، مایر هیچ گاه به ایدهی پیش بینی عناصر و تصحیح اوزان اتمی نرسید. بعد از چند ماه از اینکه مندلیف جدول تناوبی خود را از همهی عناصر کشف شده منتشر کرد (و بعضی از عناصر جدید را برای تکمیل جدول پیش بینی کرد، بعلاوه وزن اتمی بعضی از عناصر را نیز تصحیح کرد)، مایر جدول واقعا مشابه خودش را منتشر کرد. زمانی که عدهی کمی از مردم مایر و مندلیف را به عنوان خالقان مشترک جدول تناوبی تصور میکردند، اکثرا بر این عقیده بودند که مندلیف خودش این جدول را منتشر کرده و پیش بینی دقیق خواص عناصر کشف نشده توسط مندلیف باعث شد تا سهم بیشتری از این اعتبار به او برسد. در هر زمینهای، در طول زمان پیش بینیهای مندلیف بسیار افراد معاصرش را تحت تاثیر قرار میداد و همگی نیز سرانجام درست بودند. یک شیمیدان انگلیسی به نام ویلیام اودلینگ (William Odling)، همچنین یک جدول در سال ۱۸۶۴ تهیه کرد که به صورت قابل توجهی شبیه جدول مندلیف بود.
اصلاحات جدول تناوبی
هنری موزلی
در سال ۱۹۱۴ هنری موزلی رابطهای بین طول موج پرتو X عنصر و عدد اتمی آن (Z) پیدا کرد، بر این اساس جدول را دوباره و این بار بیشتر بر پایهی بار اتمی مرتب کرد. قبل از این کشف، اعداد اتمی فقط اعدادی پی در پی بر اساس وزن اتمی بودند. کشف موزلی نشان داد که اعداد اتمی یک پایهی اندازهگیری تجربی دارند.
به این شیوه موزلی با این وجود که آرگون وزن اتمی بیشتری (۳۹٫۹) نسبت به پتاسیم (۳۹٫۱) دارد، آرگون (Z=18) را بر اساس طول موجهای پرتو X قبل از پتاسیم (Z=19) قرار داد. چیدمان جدید با خواص شیمیایی عناصر تطابق داشت، زیرا آرگون یک گاز نجیب و پتاسیم یک فلز قلیایی است. به طور مشابه، موزلی کبالت را قبل از نیکل قرار داد، و همچنین میتوانست توضیح دهد که تلوریم قبل از ید قرار میگیرد بدون بازبینی در وزن اتمی تجربی تلوریم (۱۲۷٫۶) که توسط مندلیف پیشنهاد شده بود.
تحقیق موزلی همچنین نشان داد که فضاهای خالی در جدول در اعداد اتمی ۴۳ و۶۱ وجود دارد که اکنون به عنوان عناصر تکنسیم و پرومتیم شناخته میشوند، البته باید به این نکته توجه کنیم که هر دو این عناصر پرتوزا بوده و به صورت طبیعی وجود ندارند. هنری موزلی با پیروی از دیمیتری مندلیف همچنین عناصر جدیدی را پیش بینی کرد.
گلن سیبورگ
در طول پروژهی تحقیقاتی منهتن در سال ۱۹۴۳ گلن سیبورگ (Glenn T.Seaborg) با یک مشکل پیش بینی نشده در جدا سازی امریسیم (۹۵) و کوریم (۹۶) مواجه شد. او شروع کرد به تفکر در این مورد که این عناصر بیشتر به نظر میرسد که به سریهای متفاوت تعلق دارند که این مساله تفاوت خواص شیمیایی پیش بینی شدهی عناصر جدید را توجیه میکند. در سال ۱۹۴۵، او برخلاف نصیحت همکارانش عمل کرد و پیشنهاد یک تغییر مهم در جدول تناوبی را داد: سری اکتنید.
نظریه اکتیند سیبورگ دربارهی ساختار الکترونی عنصر سنگین که پیش بینی میکرد که اکتنیدها یک سری گذار مشابه با سری نادر عناصر لانتانید تشکیل میدهند، اکنون در جوامع علمی کاملا مورد قبول واقع شده و در تمام فرمهای استاندارد جدول تناوبی وجود دارد. سری اکتنید ردیف دوم بلاک f (سری ۵f) است و شامل عناصر از اکتنیم تا لورنسیم میشود. بسطهای متعاقب نظریه اکتنید سیبورگ یک فرضیه بوجود آورد که یک سری از عناصر فوق سنگین در سری زیر سری اکتنید وجود دارد که شامل عناصر ۱۰۴ تا ۱۲۱ میشود و یک سری سوپر اکتنید نیز وجود دارد که شامل عناصر از ۱۲۲ تا ۱۵۳ میشود. (البته در صورت کشف این عناصر این سری پیش بینی شده است).
جدول تناوبی چارلز ژانت (چارلز جانت)
در نمایش معمول جدول تناوبی ، هر ستون جدول شامل عناصر با آرایش الکترونی لایه ظرفیت مشابه است.در این مورد، عنصر مورد نظر lawrencium لارنسیوم، شماره ۱۰۳ (همراه با عنصری که بالای آن قرار دارد، لوتیتیم، شماره ۷۱) است. به طور معمول شما در قسمت پایین سمت راست عنصر را پیدا خواهید کرد، آخرین عنصر در اکتینیدها، در پایین دو ردیف زیر قسمت اصلی جدول اضافه شده است. اما در حقیقت لارنسیوم باید در نقطه اصلی بین عناصر ۸۸ و ۱۰۴ قرار گیرد.
با کمال تعجب ،اساس این موقعیت چند دهه قبل ایجاد شد، اما به طور گسترده ای توسط متخصصان شیمی و فیزیکدان و ناشران کتاب درسی نادیده گرفته شد، احتمالا به این دلیل که آنها هیچ وقت از فردی که آن را فاش نکرده بود شنیدند. او چارلز ژانت Charles Janet، دانشمند آمریکایی فرانسوی بود. جانت در سال ۱۸۴۹ در پاریس متولد شد، به مدرسه مهندسی رفت و در نهایت به کسب و کار پدرش (کارخانه قلم مو) پیوست و ثروتمند شد. اوقات فراغت او شامل جمع آوری فسیل ها و انتشار مقالات علمی در مورد آنها و نیز موضوعات دیگر مانند زمین شناسی، گیاهان و به ویژه حشرات اجتماعی سپری می شد.
در اواخر دهه ۱۹۲۰، ژانت توانایی های درخشان خود را به عناصر شیمیایی تبدیل کرد. او نسخه های جدیدی از جدول تناوبی را طراحی کرد. بر خلاف بسیاری از جداول دیگر که قبل از آن ساخته شده بود، دلایل و طراحی های او نظم و ترتیب در ترتیب الکترونهایی که هسته اتم را در بر می گیرند بود.
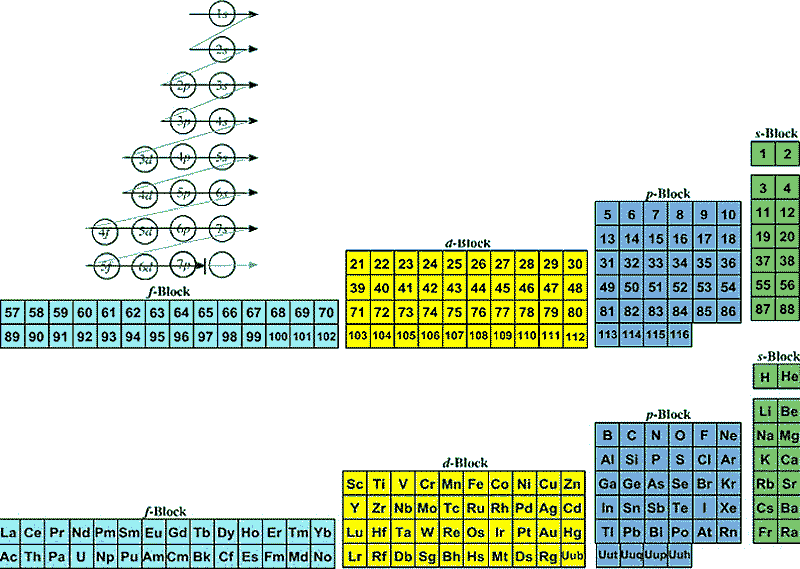
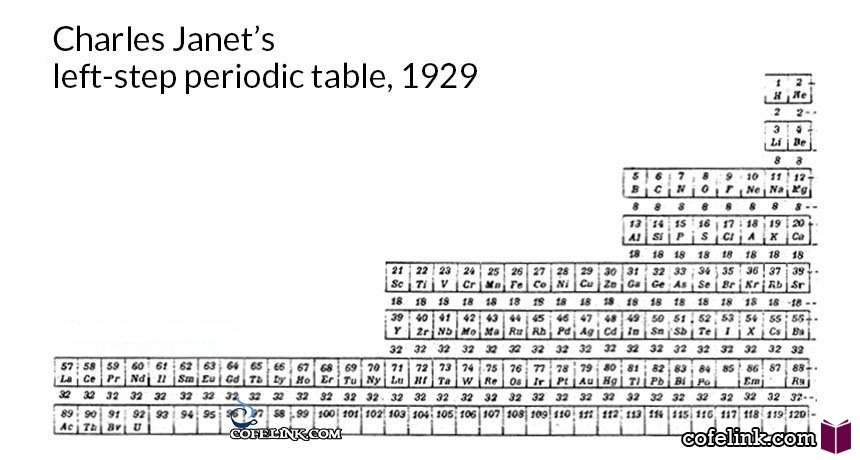
چارلز ژانت در سال ۱۹۲۹ مطابق شکل زیر جدول تناوبی خود را از راست به چپ مرتب کرد و عناصر گروه اول دوم جدول تناوبی را به سمت راست جدول خود منتقل کرد
ژانت چگونگی قرار گرفتن عناصر جدول تناوبی خود را بر اساس اعداد کوانتومی و لایه های الکترونی در سال ۱۹۳۰ به صورت زیر ارائه داد
همان طور که در شکل شماره ۱ ملاحظه می کنید در جدول تناوبی چارلز ژانت عناصر دسته s در سمت راست و زیر هم و به همین ترتیب عناصر دسته p در ستون های ۳ تا ۹ جدول ژانت قرار می گیرند و به همین ترتیب بر اساس آرایش الکترونی عناصری با عدد های اتمی بیشتر از ۱۱۸ ( در جدول و شکل شماره ۱ تا عدد اتمی ۱۷۰) می توان در جدول تناوبی چارلز ژانت قرار داد.در الگوی جدول تناوبی ژانت با پر شدن زیر لایه s ، هر دوره تمام می شود. و همین طور با یک الگوی منظم ازهر دو دوره یک زیرلایه اضافه می شود و به همین ترتیب باید در دوره هفتم دسته f وارد شود و در دوره نهم زیر لایه g را پیش بینی می توان کرد .همانطور که ملاحظه میشود این جدول بر اساس دوره نیست بلکه براساس نوع زیر لایه هاست لذا عنصر ۱۲۱ با زیر لایه g در سمت چپ جدول قرار می گیرد.
نکاتی درمورد جدول شارل ژانت :
۱- جدول تناوبی شارل ژانت هشت دوره و چهارده گروه دارد.
۲- هنگام نوشتن آرایش الکترونی ، بعد از پرشدن زیرلایه ۸s الکترون درزیرلایه ۵g قرارمی گیرد.
۳- زیرلایه g دارای ۹ ارببتال است پس حداکثر گنجایش ۱۸ الکترون رادارد .
تفاوت های جدول تناوبی بسط یافته با جدول تناوبی شارل ژانت :
۱-درجدول گسترش یافته ، که بسط یافته جدول مندلیف است ، عناصر دسته s سمت چپ هستند ولی درجدول ژانت عنصر دسته s در سمت راست.
به عبارتی درجدول گسترش یافته مندلیف ، هردوره با اربیتالs شروع وبا اربیتال p پایان می یابد. درحالیکه درجدول ژانت با پرشدن s ، هردوره تمام می شود.
۲- زیرلایه s ، به عنوان زیرلایه اول ، در جدول گسترش یافته از دوره اول شروع می شود ، درجدول ژانت هم از دوره اول . ولی تفاوت اینکه درجدول گسترش یافته فقط دوره اول شامل یک زیر لایه (۱s ) می باشد ، ولی در جدول ژانت دو دوره فقط دارای یک زیرلایه ، هستند .( زیرلایه ۱sدردوره اول پرمی شود شامل هیدروژن وهلیم و زیرلایه۲s دردوره دومپرمی شود ، شامل لیتیم وبریلیم)
۳- زیرلایه p ، به عنوان زیرلایه دوم در جدول گسترش یافته از دوره دوم شروع می شود . ولی در جدول ژانت از دوره سوم
۴- زیرلایه d ، به عنوان زیرلایه سوم درجدول بسط یافته از دوره چهارم وارد می شود .ولی درجدول ژانت از دوره پنجم
۵-زیرلایه f به عنوان زیرلایه چهارم ، درجدول گسترش یافته از دوره ششم وارد می شود .ولی در جدول ژانت از دوره هفتم
۶- زیرلایه g به عنوان زیر لایه s پنجم ، در جدول گسترش یافته ، از دوره هشتم وارد می شود ولی در جدول ژانت ازدوره نهم
۷-در جدول گسترش یافته ، فقط دوره اول دو عنصری هستند ( شامل هیدروژن وهلیم ) ولی درجدول ژانت ، هریک از دوره های اول ودوم دارای دو عنصر هستند : دوره اول مثل جدول مندلیف ، شامل دوعنصر هیدروژن وهلیم .ودوره دوم هم دارای دوعنصر لیتیم وبریلیم .
امتیاز و ویژگی های جدول ژانت
۱- نمایش عناصر به صورت پیوسته وبدون فاصله یا شکاف
۲- نمایش اربیتالهای پرشده واضح تر از شکل رایج
۳- بر طبق جدول شارل به خاطر ورود زیرلایه g که ۹ اربیتال دارد ، دوره های هشتم و نهم داریم.
۴- عناصر برحسب قرار گرفتن الکترون درزیرلایه ها درکنار هم قرار گرفته اند .
۵- مرتب شدن براساس افزایش عدداتمی
۶- حوه ی پرشدن جدول با اصل آفبا همخوانی دارد .
اشکالات جدول ژانت :
۱-دراین جدول انتقال آسان ومشخص و روند تناوبی از فلز به نافلز وجودندارد .
۲-هلیم در جایگاه اصلی خود که گاز نجیب است ، قرار ندارد .
دانلود بصورت فایل PDF




























نرگس
2024-06-21 at 12:48 ق.ظ
سلام خسته نباشید مقاله خیلی خوبی بود
فقط اینکه چرا جدول چهارده گروه داره؟
برار
2023-08-21 at 8:43 ب.ظ
برا پیدا کردنه الکترون ظرفیت و گروه و ردیف و عدد اتمی و …
همون فرمول های جدول مندلیفه یا فرق داره؟
تینا اسدی
2021-12-21 at 3:35 ب.ظ
الان جدید ترین جدول ارائه شده ژانته؟
ناشناس
2021-11-09 at 5:32 ب.ظ
منبع رو ذکر نکردید
N
2021-10-28 at 12:38 ب.ظ
سلام به عنوان تحقیق باذکر کافه لینک میتونم استفاده کنم ازین مقاله؟
سجاد سیف
2021-10-28 at 4:09 ب.ظ
بله حتما/ اگر آدرس وب سایتمون رو هم بنویسید ممنون میشیم
ناشناس
2020-10-21 at 10:15 ق.ظ
Merc as shoma
هانیه
2020-09-29 at 9:35 ب.ظ
عالی بود خدا خیرتون بده
amir
2020-01-15 at 8:12 ب.ظ
این فوق العاده بود i love chemistry
ayda
2018-10-05 at 2:14 ب.ظ
کاش درمورد شیوه پیدا کردن موقعیت یک عنصر هم میگفتین
Sara
2019-09-30 at 10:09 ب.ظ
گاز نجیب ها رو حفظ کنید و عدد اتمی هاشونو بعد هر عنصری که بهتون بدن از طریق مقایسه عدد اتمیشون با گاز نجیب به راحتی موقعیت مشخص میشه
عاطفه
2018-09-30 at 11:09 ب.ظ
mrc
awwwllli
سجاد سیف
2018-10-01 at 9:49 ق.ظ
خوشحالیم که بدردتون خورد
نرگس
2018-09-23 at 8:05 ب.ظ
Awli bood🤗👌
سجاد سیف
2018-09-23 at 9:42 ب.ظ
ممنونم نرگس جان